Osteosarcoma
La denominación “osteosarcoma” se aplica a un grupo heterogéneo de neoplasias malignas de células fusiformes que tienen como rasgo común la producción de hueso inmaduro, también denominado “osteoide”. El grado de malignidad, y la consiguiente tendencia a metastatizar (o diseminarse), viene determinada por el grado histológico (esto es, la imagen que ofrece en el estudio microscópico). Esta familia de sarcomas incluye desde variantes en los que la curación queda garantizada únicamente con cirugía, hasta casos letales incluso tras las más agresivas medidas terapéuticas.
A pesar de que las tasas de curación pueden aproximarse al 65-70% en casos de enfermedad localizada tratados con terapia multimodal, el tratamiento suele ser largo y arduo, y con frecuencia tiene una duración de un año o incluso superior. Dada la progresiva mejora en la tasa de supervivencia, de manera continua, surgen nuevos nuevos desafíos en relación a los cuidados a largo plazo de los pacientes con osteosarcoma. Por consiguiente, la asistencia de los pacientes con osteosarcoma se lleva a cabo de forma óptima en un centros multidisciplinares, donde se dispone de manera más directa y rápida, de los recursos y el personal requerido para el cuidado de estos complejos casos.
Nos centraremos en el osteosarcoma Central de alto grado clásico, si bien, según proceda, se hará referencia a los subtipos existentes. Es también muy importante señalar que este artículo no pretende en ningún caso ser exhaustivo, sino ofrecer un resumen de los conocimientos actuales sobre el tema que faciliten la comunicación entre el enfermo y el médico.
Epidemiología
El osteosarcoma es el tumor primario óseo sólido más frecuente, constituyendo aproximadamente un 20% de los sarcomas primarios de hueso (Dahlin 1986). Cada año se diagnostican de 400 a 1000 casos nuevos en Estados Unidos (Marina 2004, Gibbs 2001), lo que supone una incidencia de 3/1.000.000 en la población general. Es con mucho una enfermedad de la edad juvenil; más del 75% de los casos aparecen en pacientes menores de 25 años (Mirra 1989). Los casos aparecidos en adultos corresponden a sarcomas secundarios, esto es, sarcomas surgidos como complicación de enfermedades óseas preexistentes (enfermedad de Paget, osteomielitis crónica, infartos óseos) o sobre tejidos previamente irradiados.
El osteosarcoma es algo más frecuente en varones, quizá debido a la mayor duración en ellos de la fase de crecimiento del esqueleto comparada con la de las mujeres (Dorfman 1988). La excepción a esta tendencia la constituye el sarcoma parostal, más frecuente en mujeres y en un grupo de edad ligeramente superior (Dahlin 1986). No se ha observado predilección por etnia o raza (Buckley 1998, Dorfman 1998, Weiss 1998).
Patogénesis y Aspectos Moleculares
Aunque se ha conseguido cierto grado de conocimiento sobre la cuestión, la respuesta a esta pregunta continúa siendo un misterio en la mayoría de los casos. Fuchs y Pritchard (2002) dividieron los agentes causales “conocidos” en químicos, víricos, físicos (radiaciones) y otros (misceláneos). Los agentes químicos, que parecen actuar produciendo alteraciones genéticas, incluyen compuestos de berilio y metilcolantreno. Rous et al (1912) fueron los primeros en publicar la existencia de una causa vírica demostrable para los sarcomas. El virus del sarcoma de Rous (un retrovirus, esto es, un virus dotado de RNA) contiene un gen denominado V-Src, que tiene en las células normales un homólogo no patógeno, es decir, un proto-oncogén.
Así como algunos virus se han asociado con la inducción de tumores óseos, FJB es el único agente viral aislado de un sarcoma aparecido de novo y es conocido como un potente inductor de la aparición de osteosarcomas en ratones. El oncogén del FBJ está relacionado con un proto-oncogén (presente en condiciones normales en las células) llamado c-Fos, que ha demostrado estar asociado a una pobre respuesta a la quimioterapia en pacientes con osteosarcoma.
La radiación parece desempeñar un papel crítico en la aparición de muchas neoplasias. Su papel en el desarrollo del osteosarcoma queda bien definida por su asociación con la aparición de sarcomas secundarios años después del tratamiento radioterápico de otras neoplasias, entre las cuales el osteosarcoma es una variante histológica habitual (Enzinger 1995, Tucker 1990, 1987, 1985, Huvos 1985, Weatherby 1981).
Se han sugerido otras causas de diversa índole. La asociación del osteosarcoma con la enfermedad de Paget del hueso es bien conocida, sucediendo en aproximadamente el 1% de los pacientes afectados por dicha enfermedad. Aunque el mecanismo exacto es aún desconocido, se ha sugerido como posible desencadenante una pérdida de heterocigosidad que afectaría al cromosoma 18 (Hansen 1999, McNairn 2001).
Una de las alteraciones genéticas asociadas con el osteosarcoma mejor caracterizadas es la pérdida de heterocigosidad del gen del retinoblastoma (RB). El producto de este gen es una proteína que actúa suprimiendo el crecimiento de las células con DNA dañado (esto es, se trata de un gen supresor tumoral). La pérdida de función de este gen permitiría a las células crecer de forma descontrolada, llevando a la aparición de diversos tumores, incluido el osteosarcoma.
La presencia de esta mutación se ha asociado con tasas de supervivencia disminuidas en pacientes con osteosarcoma (Feugeas 1996). TGF-β es un factor de crecimiento cuyas cifras se elevan más en los osteosarcomas de alto grado que en las lesiones de bajo grado (Franchi 1998); es un bien conocido inhibidor del producto del gen RB contribuyendo quizá al comportamiento agresivo de estos tumores. También asociadas con el osteosarcoma están las mutaciones de p53, otro gen supresor; en la mayoría de los osteosarcomas se encuentra algún tipo de inactivación combinada de RB y p53 (Ladanyi 2003).
El receptor para el factor de crecimiento epidérmico (HER-2 o ERB-2) es otra alteración molecular asociada con el osteosarcoma. Su sobreexpresión se relaciona con tumores de curso clínico más agresivo, de potencial metastásico incrementado, intervalos libres de enfermedad más cortos y peores tasas de supervivencia global. Se han referido asociaciones similares para la glucoproteína P, un importante mediador de resistencia multidroga en las células tumorales (Ferrari 2004, Pakos 2003, Park 2001, Hornicek 2000), y para VEGF, un factor de crecimiento responsable de la angiogénesis tumoral. Si bien existen numerosas variaciones citogenéticas en los osteosarcomas, la presencia de patrones diagnósticos predecibles permanece ausente de forma generalizada.
Presentación Clínica
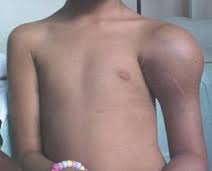
Los síntomas que con más frecuencia llevan a los pacientes con osteosarcoma a solicitar atención médica son el dolor y la aparición de una masa palpable, evidenciable en hasta 1/3 de los pacientes en la primera visita.
En niños más pequeños la cojera puede ser el único síntoma. El dolor puede llevar muchos meses presente y ser inicialmente confundido con causas más corrientes como contracturas musculares, daño por sobrecarga o “dolores de crecimiento.” Con frecuencia no es hasta que se produce un traumatismo en la extremidad afecta y se realiza un estudio radiográfico cuando se evidencia la anomalía ósea.
Desafortunadamente, si la fractura tiene lugar sobre el hueso debilitado por la neoplasia (la denominada “fractura patológica”), la tasa de recidiva local tras la cirugía se incrementa, y disminuye la expectativa global de supervivencia del paciente (Scully 2002). Un alto índice de sospecha acompañado de un cuidadoso examen de la articulación pueden disminuir la frecuencia de estos retrasos diagnósticos y los riesgos asociados.
El dolor que no se resuelve con medidas convencionales, su persistencia en reposo o el que despierta al paciente por la noche debe alertar al médico de la necesidad de realizar una evaluación más profunda. Una vez que se sospeche de la presencia de un tumor, la derivación del paciente a un oncólogo especialista músculo-esquelético debe de quedar garantizada.
Como sucede con la mayoría de los sarcomas, los pacientes habitualmente no se sienten ni parecen “enfermos”. La aparición de fiebre, mal estado general u otros síntomas constitucionales no son típicos del osteosarcoma. Los estudios de laboratorio pueden ser de ayuda, pero los resultados no son específicos del osteosarcoma. La tasa de sedimentación, los niveles de proteína C reactiva, fosfatasa alcalina (ALP) y lactato deshidrogenasa (LDH) pueden estar elevados. Se ha sugerido que la elevación pretratamiento de ALP, presente en aproximadamente el 50% de los pacientes, pudiera asociarse con un riesgo aumentado de recidiva (Bacci 1993). La elevación de la LDH se relaciona con un peor pronóstico, pues presumiblemente es indicativa de tumor con mayor agresividad biológica (Bacci 1994, Meyers 1992).
Características Radiológicas del Osteosarcoma
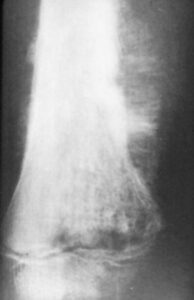
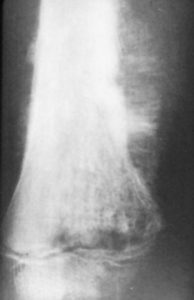
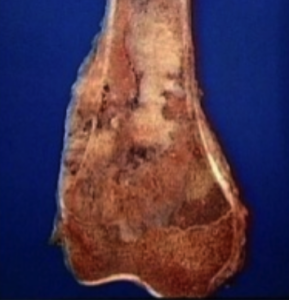
En la mayoría de las variantes de osteosarcoma una radiografía simple es prácticamente diagnóstica. Típicamente las lesiones se sitúan en las metáfisis (extremos) de los huesos largos, más frecuentemente en la rodilla.
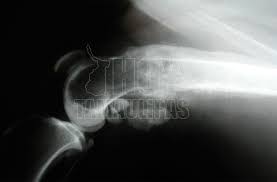
Las lesiones son de límites mal definidos, acompañadas de desctrucción del hueso cortical y medular, y muestran osificación en el interior del componente de partes blandas (Gebhardt 2002, Gibbs 2001). Las lesiones pueden ser radiolúcidos, radiodensas o mixtas, dependiendo del grado de mineralización del osteoide. Las variantes “de superficie” son diferentes, en tanto en cuanto parecen “descansar” sobre el hueso. La afectación destructiva del canal medular está ausente de forma típica en las lesiones “de superficie”, aunque pueden ser evidentes en enfermedad avanzada.
Los osteosarcomas telangiectáticos son con frecuencia completamente radiolúcidos, pudiendo ser confundidos con tumores líticos benignos como quistes óseos aneurismáticos.
Otras modalidades de estudio de imagen tienen su papel en la evaluación inicial de una lesión sospechosa de osteosarcoma, especialmente la resonancia magnética nuclear (RMN). La RMN ha sustituido a la tomografía computerizada (TC) como prueba de elección en la determinación de la extensión de enfermedad local. Aunque la TC detalla mejor la extensión de la destrucción ósea, la MRI tiene la ventaja de proporcionar imágenes axiales múltiples, un mayor detalle en la valoración del componente de partes blandas y en la relación del tumor con estructuras neurovasculares adyacentes. Es además más sensible a la hora de cuantificar la extensión de la afectación intramedular.(Estrada 1995, Gillespy 1988, Sundaram 1987).
Las proyecciones T1 coronal y sagital se utilizan para mostrar la extensión intramedular de la neoplasia, mientras que las proyecciones axiales en T2 permiten visualizar mejor el componente de partes blandas (Gillespy 1988). Además, la RMN con contraste permite una visualización precisa de la relación del tumor con las estructuras adyacentes (por ejemplo, nervios, vasos sanguíneos y músculos), convirtiéndola en una muy valiosa técnica para la estadificación y planificación quirúrgica.
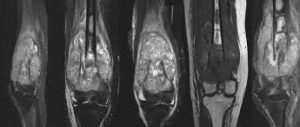
Como la RMN no conlleva la exposición del paciente a la radiación ionizante, proporciona además una vía segura y precisa para el seguimiento de la respuesta al tratamiento y el rastreo de recidivas mediante estudios periódicos (si bien las reconstrucciones con prótesis metálicas o placas óseas pueden afectar el detalle de imagen de la RMN).
La gammagrafía ósea (escintigrafía nuclear) y el FDG-PET son técnicas adicionales útiles, pero más adecuadas en la estadificación que en la evaluación de la lesión primaria. La mayor utilidad del escáner óseo en la evaluación del osteosarcoma radica en la detección de depósitos metastásicos en otros puntos[/vc_column_text][/vc_column][vc_column width=”1/2″][vc_column_text]Estadificación del Osteosarcoma
Una vez sospechado un osteosarcoma, debe de realizarse una estadificación o estadiaje. Hay tres preguntas básicas que han de ser respondidas en esta fase:
- ¿Cómo es de agresivo el tumor (¿Cuál es su grado?)
- ¿Cuánto se extiende?
- ¿Se ha diseminado?
El grado hace referencia a la apariencia de agresividad biológica que muestra el tumor. Se basa en rasgos histológicos valorados en la toma biópsica. La mayor parte de los osteosarcomas son considerados de alto grado (de alta malignidad). La extensión se refiere a si el tumor ha crecido o no más allá de su compartimento de origen (en el caso del osteosarcoma, si ha erosionado y traspasado el hueso alcanzando las partes blandas adyacentes o no). La diseminación de cualquier tumor a otro lugar del organismo se denomina metástasis.
El estudio mediante RMN de la totalidad del hueso afecto es necesario no sólo para evaluar la extensión de la lesión primaria sino también para buscar metástasis ocultas, que pueden no ser vistas en el escáner óseo. Estas últimas son focos metastásicos en el interior (o a distancia) del hueso de origen y aparecen en menos del 5% de los osteosarcomas (Campanacci 1999). Su presencia confiere un peor pronóstico pese a los continuos avances en la terapia adyuvante (Wuisman 1990, Sajadi 2004).
Los pacientes con enfermedad metastásica tienen generalmente un pronóstico peor que aquéllos sin metástasis detectables en el momento del diagnóstico. Es comúnmente aceptado que alrededor del 80% de los pacientes con osteosarcoma de alto grado tienen micrometástasis en el momento del diagnóstico, aunque no existen pruebas analíticas de sangre disponibles para la detección de este tipo de enfermedad metastática (Link 1986).
En el estadiaje, el término metástasis hace referencia a aquéllas que pueden ser detectadas mediante técnicas de imagen (menos del 20% de los pacientes con osteosarcoma, ver Ferguson 2001). Los lugares más frecuentes de diseminación del osteosarcoma son el pulmón y el hueso. Por tanto, la radiografía y el TAC de tórax y el escáner óseo son esenciales en el proceso de estadificación.
BIOPSIA
Las técnicas “abiertas” hacen referencia a la cirugía, que se realiza en el quirófano. Estas proporcionan la mayor cantidad de tejido a evaluar por el patólogo, aunque frecuentemente no son necesarias, puesto que habitualmente puede realizarse una biopsia con trefina de la masa de partes blandas. Para que esta técnica sea útil es necesario contar con un patólogo experimentado en la evaluación de material obtenido mediante biopsia con aguja. Una vez elegida esta técnica diagnóstica, es el cirujano o el radiólogo el que, bajo control de imagen guiado con intensificador de imagen o TC, la lleva a cabo. La colocación de la aguja puede ser dirigida por el cirujano, que además realizará la extirpación definitiva cirugía conservadora de la articulación (Mankin 1996, 1982).
Una vez realizada la evaluación patológica y asignado el grado histológico, toda la información es integrada a fin de definir la “personalidad” del tumor. Uno de los sistemas más habituales y sencillos utilizados en la oncología músculo-esquelética es la de Enneking et al (1986, 1980);
Tabla 1: Estadificación Quirúrgica de los Sarcomas (adaptado de Enneking 1980)
| Estadio | Grado | Localización |
| IA | Bajo | Intracompartimental (en el compartimento óseo o muscular de origen) |
| IB | Bajo | Extracompartimental |
| IIA | Alto | Intracompartimental |
| IIB | Alto | Extracompartimental |
| III | Cualquiera + Metástasis | Cualquiera + Metástasis |
Utilizando este sistema, la mayor parte de los pacientes con osteosarcoma se encontrarían en un estadio IIB de la enfermedad. Este implica la existencia de un tumor de alto grado con extensión a partes blandas y sin metástasis detectables.
Características microscópicas
El osteosarcoma osteoblástico
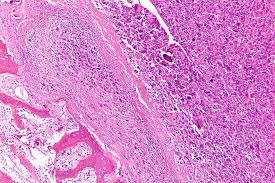
está constituido en el examen microscópico por osteoblastos de aspecto maligno dispuestos sobre una matriz constituida mayoritariamente por hueso compacto.

El osteosarcoma condroblástico consta de una matriz de apariencia cartilaginosa dotada de lagunas en las que se disponen células fusiformes malignas.
La variante fibroblástica tiene la morfología de una neoplasia maligna de células fusiformes, en las que el único indicador de que se trata de un osteosarcoma es el escaso osteoide identificable. De forma habitual el tumor tiene una morfología mixta. Aunque el conocimiento de estas variantes puede ayudar al patólogo a considerar el diagnóstico de osteosarcoma cuando la histología no es clara, no hay datos que sustenten la existencia de diferencias en el comportamiento clínico o en el pronóstico basados en criterios microscópicos (Marina 2004).
Existen otros subtipos histológicos con relevancia clínica. El osteosarcoma parostal es una variante superficial de bajo grado. Microscópicamente está compuesto por un estroma fibroso de bajo grado, con menos atipia celular y mitosis que el osteosarcoma convencional (Okada 1994). Puede además mostrar una cubierta cartilaginosa similar a la del osteocondroma (Wold 1990).
En raras ocasiones puede originarse en él un sarcoma de alto grado (Sheth 1996, Wold 1984).
El osteosarcoma periostal es una neoplasia de superficie de grado intermedio. Se origina con más frecuencia en la diáfisis de los huesos largos y habitualmente muestra histología condroide. El osteosarcoma telangiectático puede asemejarse radiográfica e histológicamente a un quiste óseo aneurismático. La presencia de atipia celular y de producción de osteoide, aunque habitualmente escaso, distingue y caracteriza a esta variante de alta malignidad (Wold 1990).
Tratamiento del Osteosarcoma
En los últimos treinta años hemos asistido a un enorme progreso en el tratamiento del osteosarcoma. El reconocimiento de la importancia de la terapia multimodal sumado a los avances en las técnicas de imagen son en gran medida responsables de ello. No sólo se han conseguido mejorías drásticas en la supervivencia, sino también en la habilidad para llevar a cabo de forma segura procedimientos de conservación de la extremidad en la mayoría de los pacientes con osteosarcoma.
El tratamiento estándar de los pacientes con osteosarcoma convencional incluye una combinación de quimioterapia y cirugía. Existe cierta controversia acerca de la duración de la quimioterapia y de la idoneidad de su aplicación, después (adyuvante) o antes de la cirugía. La segunda de ellas es denominada quimioterapia “neoadyuvante”. En lo que sí existe consenso general es en que tanto la cirugía como la quimioterapia por sí solas son insuficientes para el tratamiento del osteosarcoma clásico de alto grado.
En el caso de variantes de superficie de bajo grado, la cirugía por sí sola puede ser curativa. Aunque la quimioterapia puede estar indicada en lesiones de grado intermedio, no está claro que sea una indicación universal y su aplicación debe basarse en la valoración individual de cada caso.
Quimioterapia
El osteosarcoma debe de ser considerado una enfermedad sistémica. Se estima que aproximadamente el 80% de los pacientes tienen enfermedad micrometastásica en el momento del diagnóstico, a pesar de que sólo en un 10-20% de los casos ésta puede ser inicialmente detectada con técnicas de imagen convencionales (Ferguson 2001). En este hecho se sustenta la utilización de quimioterapia sistémica. Se ha demostrado que la quimioterapia, cuando se combina con la cirugía, produce un claro beneficio en los casos de osteosarcoma. Los mejores resultados en cuanto a supervivencia se evidencian en pacientes con enfermedad no metastásica.
Una vez que se ha producido diseminación “detectable”, el tratamiento se hace mucho más dificultoso y los resultados son menos predecibles, si bien con quimioterapia agresiva y cirugía aún es posible obtener periodos de supervivencia prolongada en cerca del 50% de los casos.
En un estudio randomizado, Link et al (1991) encontraron periodos de supervivencia libres de enfermedad en el 17% de los pacientes tratados sólo con observación tras la cirugía frente al 66% de los pacientes que recibieron quimioterapia. Las diferencias de supervivencia entre ambos regímenes se incrementan con el tiempo (Link 1993).
Esta modalidad terapéutica es, en la actualidad, la predominante en la mayoría de los centros. A pesar de que la administración de neoadyuvancia retrasa la cirugía aproximadamente 3 meses, tiene ciertas ventajas. Así, permite la valoración del grado de necrosis tumoral (muerte de las células neoplásicas) en el momento de la resección. Esto ofrece una valiosa información sobre el comportamiento de un tumor en particular.
En general, porcentajes de necrosis superiores al 90% son consideradas una buena respuesta a la quimioterapia. Menos claro está qué conducta adoptar ante porcentajes de necrosis inferiores al 90%, dado que no se ha demostrado que el cambio de régimen quimioterápico en pacientes con pobre respuesta al tratamiento mejore la supervivencia global (Ferguson 2001).
Tradicionalmente la quimioterapia se administraba tras la cirugía. Con el surgimiento de los procedimientos de conservación del miembro utilizando prótesis o Aloinjertos, algunos centros comenzaron a dar quimioterapia previa a la cirugía, en un esfuerzo por comenzar el tratamiento lo antes posible. Esto llevó a considerar la terapia neoadyuvante con cirugía posterior como sistema de tratamiento preferible (Rosen 1979).
Otra ventaja de la quimioterapia preoperatoria es que muchos tumores experimentarán una “consolidación” o “condensación”, haciendo más factible y segura la resección quirúrgica. La quimioterapia preoperatoria, aunque por las razones previamente citadas se considera de ayuda, no ha demostrado ser capaz de mejorar la supervivencia global libre de complicaciones en los pacientes con osteosarcoma (Goorin 2003), tal y como se creía inicialmente (Rosen 1979).
Los protocolos habituales para el osteosarcoma incluyen fármacos como la doxorrubicina, metotrexate en alta dosis, cis-platino e ifosfamida. Efectos secundarios como la toxicidad cardíaca o la supresión de la medula ósea pueden requerir el reajuste o incluso la suspensión del régimen suministrado.
El estudio previo a la terapia, que incluye un ecocardiograma y analíticas sanguíneas, es realizado de rutina como punto de partida para evaluar la función cardíaca y renal antes de iniciar un tratamiento potencialmente tóxico. Antes de iniciar la quimioterapia, debe abordarse con el oncólogo una exhaustiva discusión referida a los fármacos a emplear , el tiempo de administración y la toxicidad/efectos secundarios potenciales.[/vc_column_text][/vc_column][/vc_row][vc_row][vc_column][vc_column_text]
Cirugía
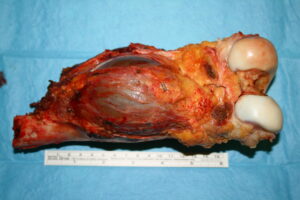
El osteosarcoma es una enfermedad quirúrgica. Una vez detectado, el tumor debe de ser extirpado si se busca garantizar la curación. Con mayor frecuencia, ésto se realiza tras un periodo de quimioterapia. El principal objetivo de la cirugía es extirpar el tumor de manera completa y segura.
Históricamente, la mayoría de los pacientes eran sometidos a una amputación. En los últimos 30 años, los procedimientos conservadores de la extremidad se han convertido en el estandar, principalmente debido a los avances concomitantes en quimioterapia y en sofisticadas técnicas de imagen. Estos avances han hecho posible la preservación del miembro incluso tras una fractura patológica, que previamente era una indicación absoluta de amputación (Scully 2002). Las técnicas de preservación de la extremidad pueden ofrecer en la actualidad tasas de control local y supervivencia a largo plazo equivalentes a las de la amputación.
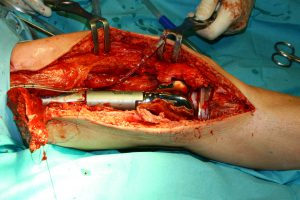
Cuando se selecciona un procedimiento quirúrgico para un paciente concreto, el objetivo oncológico de extirpar el tumor debe siempre tener prioridad sobre la conservación de la función.
Si el tumor puede extirparse de forma segura, conservando simultáneamente la extremidad viable, la técnica de conservación de la extremidad puede ser la apropiada. Si existe afectación de grandes vasos o nervios, o en caso de que la extirpación completa del tumor conlleve una pérdida significativa de función, la amputación puede ser una mejor elección. Otros factores como la edad del paciente, el nivel de funcionalidad deseado, preferencias estéticas y el pronóstico a largo plazo deben ser tenidas también en cuenta. La cirugía requiere gran cantidad de planificación y evaluación preoperatoria. El paciente es estadificado de nuevo (tal y como se describe anteriormente) antes de la cirugía a fin de determinar qué cambios han tenido lugar en respuesta a la terapia sistémica.
Habitualmente se realizan radiografías convencionales y una RMN de la lesión primaria además de un escáner corporal completo y un TAC de tórax. Estos nuevos estudios dan con frecuencia la información óptima para la planificación quirúrgica, y ayudan además a detectar y/o evaluar la presencia de cualquier otra nueva lesión o la existencia de metástasis. Debe tomarse tan pronto como sea factible una decisión sobre la cirugía recomendable, especialmente si va a realizarse preservación de la extremidad, puesto que las técnicas de reconstrucción pueden tardar semanas en planificarse.
Los procedimientos quirúrgicos se incluyen en tres categorías básicas: amputación, preservación de la extremidad y plastia-rotación. La amputación incluye la extirpación de la articulación con un margen de seguridad entre el extremo de la porción del miembro conservado y el tumor (ver resección “amplia” o “radical” en la Tabla 2).
Tabla 2: Resección quirúrgica (adaptado de Enneking 1980)
| Intralesional | Curetaje, extirpación tumoral parcial |
| Marginal | El margen es la zona reactiva limítrofe, puede quedar tumor residual |
| Amplia | Extripación del tumor y de un rodete de tejido sano circundante |
| Radical | Extirpación del compartimento completo, incluye amputación |
El pronóstico funcional tras la amputación es variable y depende de varios factores. En amputaciones de la extremidad superior, los resultados tienden a ser mejores en pacientes más jóvenes con la articulación del codo intacta. Las amputaciones de la extremidad inferior son más complejas. En un estudio se encontró que la percepción de los pacientes con amputación de la extremidad mostraban una fuerte correlación con la comodidad del muñón, el estado de la extremidad contralateral, el ajuste y función del dispositivo protésico, la percepción de cómo otros ven a los pacientes con amputaciones y de la capacidad para practicar ejercicio (Matsen 2000).
Aunque existen diferencias entre la amputación y la cirugía conservadora de la extremidad, el pronóstico a largo plazo relativo a la función y satisfacción del paciente parece ser similar (DiCaprio 2003, Refaat 2002, Nagarajan 2002).
Aunque inicialmente es más barata, a largo plazo la amputación puede ser más cara que la preservación del miembro con endoprótesis debido al coste de las prótesis y a la necesidad de su sustitución periódica (Grimer 1997). La mayor ventaja de la amputación es quizá que es una única intervención asociada con pocas complicaciones globales. Los amputados tienen además mayor libertad para la práctica continuada de deportes porque no deben preocuparse por complicaciones asociadas a las prótesis o injertos asociadas a preservación del miembro como aflojamiento o fractura.
La preservación de la extremidad consiste en extirpar el tumor con un margen de tejido circundante sano preservando entre tanto el aporte vascular y nervioso al miembro (ver “resección amplia” en la tabla 2). Una vez extirpado el tumor, el defecto esquelético debe ser reconstruido. Algunos defectos pueden ser extensos, alcanzando tamaños de 15-20 cm y requiriendo reconstrucciones complejas (DiCaprio 2003).
Como opciones se incluyen las prótesis metálicas, los aloinjertos de hueso (de cadáver), el hueso vascularizado obtenido del propio paciente o recolocación del hueso resecado tras esterilización en un autoclave. La elección debe de tener en consideración la localización y el tamaño del defecto, el pronóstico funcional que se espera y los deseos del paciente y/o de su familia. En la actualidad, las reconstrucciones endoprostéticas, con aloinjerto o combinadas (endoprótesis-aloinjerto) son las más frecuentemente realizadas.
La reconstrucción endoprostética ha alcanzado gran popularidad en la cirugía de preservación de la extremidad. Consiste en sustituir el hueso extirpado por un implante metálico. Esto elimina la necesidad de tejido óseo para que el hueso “cicatrice”, que sí es necesaria con los injertos. Habitualmente puede realizarse una rehabilitación más agresiva de forma más temprana. Las complicaciones de este tipo de reconstrucción incluyen el aflojamiento de los componentes y las heridas.
El aflojamiento aséptico sucede más en pacientes con menos de 20 años y sustituciones largas del fémur (Unwin 1996). La supervivencia global de estos implantes publicada es del 80% a los 5 años, 65% a los 10 años y del 50% a los 20 years (Damron 1997, Unwin 1996, Malawer 1995). Las tasas de infección en estas series alcanzan el 13%.
Incluso si se evitan complicaciones catastróficas, la necesidad potencial de múltiples revisiones o procedimientos de alargamiento pueden ser abrumadoras. Una publicación reciente sobre 25 pacientes con reconstrucción endoprotésica revela que 10 de ellos (40%) requirieron al menos una revisión y que el tiempo medio hasta la primera revisión fue de 4.9 años (Tunn 2004). Ruggieri et al (1993) refieren una tasa de complicaciones del 63% en procedimientos de preservación de la extremidad frente al 0% de la amputación y del 44% para la rotación-plastia. Es importante para el clinic y para el paciente comprender los riesgos inherentes y la realidad a largo plazo de sus elecciones.
Los injertos de cadáver tienen el beneficio del aporte de material biológico al hueso huésped. El factor limitante es el momento de implantación del mismo. La quimioterapia ha demostrado impedir la unión del aloinjerto al hueso huésped (Hazan 2001). Una extensa revision de más de 800 reconstrucciones con aloinjerto reveló que una supervivencia de éste superior a 3 años se asocia a una excelente supervivencia a largo plazo del mismo (Mankin 1996). Las mayores barreras para el éxito en los primeros 3 años fueron las infecciones (incidencia del 11%), fracturas (19%) y las dehiscencias o falta de unión (17%). Los aloinjertos osteoarticulares (aquéllos que sustituyen una superficie articular) afrontan el riesgo adicional del deterioro articular.
En las series previamente citadas, un 16% de los pacientes con aloinjertos osteoarticulares en la rodilla y el 20% de los de la cadera requirieron sustitución completa de la articulación una media de 5 años después de la implantación. Aspectos adicionales del uso de aloinjertos voluminosos son la transmisión de enfermedades y la respuesta inmunológica al material extraño. Aunque el “rechazo” tal y como se conoce en otros órganos trasplantados no sucede, la reacción inmunológica puede impedir la cicatrización del injerto retrasando su integración. Las restricciones por tamaño pueden ser también limitantes, particularmente en pacientes más pequeños o jóvenes, ya que los donantes son habitualmente adultos.
La plastia-rotación es una técnica intermedia entre la amputación y la preservación del miembro usado más frecuentemente en osteosarcomas del fémur distal. En esencia es una amputación intercalada en la que se conservan las estructuras neurovasculares y la porción distal del miembro (pierna), reconectándolas a la porción proximal (fémur proximal y cadera) tras extirpar el tumor. El segmento distal se gira 180 grados para que la articulación del tobillo funcione como la articulación de una rodilla, convirtiendo una amputación sobre la rodilla en una amputación bajo la rodilla a fin de posibilitar al máximo el uso de una prótesis.
Se consiguen habitualmente resultados funcionales excelentes en lo que se refiere a flexión de la “rodilla”, deambulación protésica e incluso desarrollo de actividad deportiva (Merkel 1991). Esto es debido en parte a la conservación de la sensibilidad somática y propioceptiva del pie (Winkelmann 1996). La plastia-rotación se adapta especialmente a pacientes con esqueleto inmaduro (menores de doce años) con tumores adyacentes a la rodilla, aunque ha sido realizada con éxito en pacientes de más edad. La principal desventaja de esta forma de reconstrucción es la apariencia estética. La instrucción y el consejo preoperatorio sobre la naturaleza de la operación, el curso de la terapia física post-operatoria y la apariencia de la extremidad tras la plastia-rotación son esenciales. Con frecuencia es de gran ayuda que el paciente y su familia puedan conocer a alguien a quien se le haya realizado una plastia-rotación para obtener un mejor y más realista grado de entendimiento sobre cómo vivir con una extremidad rotada.
En pacientes con esqueleto inmaduro deben de considerarse ciertos aspectos particulares, puesto que el crecimiento continuado de la extremidad no afecta puede generar problemas adicionales y requerir múltiples operaciones ulteriores. Esto es especialmente exagerado en tumores originados en torno a la rodilla, ya que sus placas de crecimiento proporcionan el 70% de la longitud total de la extremidad. Puede incluso ser necesario el bloqueo de la placa de crecimiento contralateral o el alargamiento de la extremidad ipsilateral para equilibrar las diferencias de longitud de los miembros. Para conseguir la igualdad de longitud de la extremidades se están empleando, cada vez con más frecuencia, endoprótesis modulables y expandibles. Estos implantes utilizan ejes lisos no cementados que se fijan a través de la placa de crecimiento conservada a fin de permitir que continúe, al menos en parte, su desarrollo (Neel 2004, Eckardt 1993).
Alcanzada la madurez esquelética, con frecuencia es necesaria la reevaluación para colocar una prótesis más “permanente”, con todos los riesgos asociados que conlleva, como se expuso previamente. Los riesgos son similares a los de otros procedimientos de conservación del miembro, siendo el aflojamiento y la infección los más frecuentes. A pesar de la necesidad potencial de realizar multiples procedimientos, los resultados funcionales y la satisfacción global de los pacientes parecen ser aceptables (Neel 2003, Plötz 2002, Eckardt 2000, Tillman 1997, Ward 1996, Eckardt 1993, Kenan 1991).
Pronóstico
Con los regímenes de tratamiento habitual, los pacientes con osteosarcoma sin metástasis detectables tienen tasas de supervivencia que se aproximan al 70%. Los factores que parecen tener un impacto pronóstico negativo son la localización (las axiales tienen peor comportamiento), un mayor tamaño tumoral, una pobre respuesta a la quimioterapia y la presencia de enfermedad metastásica (Bielack 2002). La más consistente y clínicamente relevante de éstas es la presencia de metástasis detectables (Bielack 2002, Marina 1993, Meyers 1993). Los pacientes que se presentan con lesiones pulmonares resecables tienen una supervivencia del 30-50% (Bacci 1997). Aquéllos con metástasis pulmonares irresecables, lesiones que no responden a la quimioterapia o con lesiones óseas múltiples tienen un comportamiento mucho peor, independientemente del tratamiento (Ferguson 2001, Bacci 1996, Meyers 1993).
Supervivencia
Una vez completado el tratamiento, se requiere un cuidadoso seguimiento para detectar signos de recidiva, metástasis y complicaciones relacionadas con el tratamiento. Esto incluye un cuidadoso examen físico, radiografías del lugar primario de origen, estudios de imagen periódicos del tórax, escáner óseo y pruebas de laboratorio.
Esta evaluación es realizada de manera periódica frecuente en el post-operatorio inmediato y con mayores intervalos en el tiempo en tanto en cuanto el paciente permanezca libre de enfermedad. Si se detecta una recidiva, debe garantizarse la realización adicional de cirugía y quimioterapia. En ella son aplicables los mismos principios que en la enfermedad primaria, aunque las tasas de supervivencia a largo plazo son inferiores (Ferguson 2001, Link 1991). Algunos datos sugieren que los pacientes con recaída temprana (menos de una año después de concluido el tratamiento) tienen un pronóstico peor que aquéllos que recaen más tardíamente (Ferrari 1997).
Conclusión
Durante los últimos 30 años el osteosarcoma ha pasado de ser una enfermedad de carácter irremediablemente fatal a un proceso potencialmente curable. La mejoría en la supervivencia a largo plazo derivada de los avances en la terapia sistémica han llevado al surgimiento de nuevos desafíos en el cuidado de estos pacientes. Como los pacientes diagnosticados de osteosarcoma viven más, la función y los parámetros de medida de calidad de vida han ido haciéndose más importantes de forma creciente. Las decisiones relativas al tratamiento deben ahora tener en consideración complicaciones que pueden surgir mucho más tardíamente en la vida del paciente.
Se confía en que una mayor comprensión de la etiología y de los mecanismos patogénicos que tienen lugar en el osteosarcoma llevarán a nuevas e innovadoras opciones de tratamiento. La investigación continuada y en cooperación de los frentes clínico y de laboratorio es necesaria para que estos futuros avances se materialicen.

